|
Electrodo negativo (cátodo)
Hacia el cátodo se dirigirán los iones
positivos (cationes) que sufrirán una reacción de reducción.
El que esta reacción se produzca, o no,
dependerá de la facilidad con que se reduzca el catión.
Hay cationes que son se reducen muy
difícilmente. Esto ocurre con los cationes de los metales alcalinos y
alcalino-térreos.
Metales menos activos como el Cu, Cr, Pb,
Ag, Ni, Zn ... se reducen más fácilmente, razón por la que en la
electrolisis de sus sales se depositan en el cátodo en su forma metálica.
En el cátodo también existe una
reacción de competencia debida a la presencia del agua. El agua trata de
reducirse para dar hidrógeno (gas)
según:
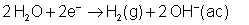
|