|
El esquema de la cuba electrolítica y de
las reacciones en ambos electrodos se puede ver a la derecha.
Consiste en dos electrodos de cobre
sumergidos en una disolución acuosa de CuSO4 y conectados a una
fuente de alimentación que suministra corriente continua.
Como se puede observar en el esquema
el cobre se deposita en el electrodo negativo o cátodo en forma
de una masa color marrón oscuro. Se deposita el cobre y no se desprende
hidrógeno (que sería una reacción de competencia) debido a que el
potencial de reducción del cobre es mucho mayor que en del hidrógeno.

En el ánodo se observa el
desprendimiento de una gas: oxígeno, ya que el ión SO42-
no se descarga al estar el azufre en su estado de oxidación más elevado y,
en consecuencia, se produce la oxidación del agua a oxígeno gas. El
oxígeno reacciona con el electrodo de cobre provocando su ennegrecimiento.
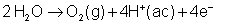 |