|
En la imagen se ha representado la
electrolisis de una disolución acuosa de NaHCO3. La sal estará
disociada en iones HCO3- y Na+. Los
primeros se desplazarán hacia el electrodo positivo, pero debido a que el
carbono está en su estado de oxidación más alto, no se oxidará. Si se
oxidará, sin embargo, el oxígeno del agua:
Observaremos, por tanto, el
desprendimiento de oxígeno en el ánodo.
Además, la disolución en esa zona disminuirá su pH debido a la aparición
de iones H+ (H3O+).
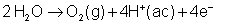
Los iones Na+ se dirigirán
hacia el cátodo, pero no se reducirán, ya que la reacción correspondiente
a la reducción del hidrógeno del agua tiene un potencial de reducción
considerablemente más alto y, en consecuencia, se verifica con
preferencia.
Si la electrolisis se realiza con electrodos de cobre el
oxígeno reaccionará con el electrodo dando una coloración azul-verdosa.
Observaremos, por tanto, el
desprendimiento de hidrógeno en el cátodo.
Además, la disolución en esa zona aumentará su pH debido a la aparición de
iones OH- .
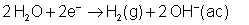 |