|

E.
Rutherford
(1871-1937)
|
E. Rutherford
realiza en 1911 un experimento crucial con el que se
trataba de comprobar la validez del modelo atómico de Thomson.
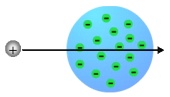
Un esquema del montaje
experimental usado se muestra más abajo:
Las partículas alfa (a),
procedentes de
un material radiactivo, se aceleran y se hacen incidir
sobre una lámina de oro muy delgada. Tras atravesar la
lámina las partículas
a
chocan contra
una pantalla recubierta interiormente de sulfuro de
zinc, produciéndose un chispazo. De esta forma era
posible observar si las partículas sufrían alguna
desviación al atravesar la lámina.
Las llamadas "partículas alfa" son núcleos de helio
(por tanto sumamente pequeñas, invisibles a la
observación directa) y cuyas características
principales son:
-
Su masa es, aproximadamente, 8.000
veces la de un electrón.
-
Tienen carga eléctrica positiva.
|
|
|
|
Si tu navegador no puede
reproducir archivos Flash:
Utiliza el navegador portable Basilisk
(opción
recomendada).
Instala la extensión
Flash Player 2021
en el navegador (al ser un emulador pueden aparecer
deficiencias en la reproducción de la película).
Puedes reproducir
los archivos .swf
en local
(en tu propio ordenador) utilizando
el visor de Flash Player . Existen visores para Windows, Mac y Linux.
Haciendo clic
aquí
encontrarás las instrucciones para
hacerlo.
Archivo .swf:
https://bit.ly/3avjPex |
|
Los resultados del experimento (una
simulación del cual puede verse a la derecha), pueden
resumirse de la siguiente manera:
-
La mayor parte de las partículas alfa
atravesaban la lámina
de oro sin sufrir ninguna desviación.
-
Muy pocas
(una de cada 10.000 aproximadamente) se desviaba
un ángulo mayor de 100
(clic en el botón Desvío)
-
En
rarísimas ocasiones las partículas
a
rebotaban en la
lámina (clic en el botón
Rebote).
|
|
|
La interpretación
dada por Rutherford fue la siguiente:
Si el modelo
atómico propuesto por Thomson fuera cierto no
deberían observarse desviaciones ni rebotes de las
partículas incidentes. Éstas atravesarían
limpiamente los átomos sin desviarse. |
 |
|
|
Para que las
partículas se desvíen, deben encontrar en su
trayectoria una zona
cuya masa sea
comparable o mayor a la de las partículas
incidentes (núcleo). Esta zona deberá tener,
además, carga positiva.
La zona en la que
se concentra la masa y la carga positiva debería
de ser muy pequeña si comparamos su volumen con el
correspondiente a la totalidad del átomo.
La carga eléctrica
(negativa) de los electrones debería estar
exactamente compensada con la positiva del núcleo,
ya que los átomos son eléctricamente neutros
(carga cero). |
|
|
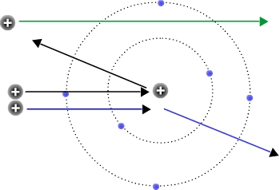
Los resultados del experimento
pueden interpretarse si suponemos un modelo
planetario de átomo con un núcleo
central (muy pequeño
en relación con la totalidad del átomo) en el que se concentra la masa y la carga
positiva. Los electrones girarían (de forma
análoga a como lo hacen los planetas alrededor del
Sol) en órbitas concéntricas alrededor de este
núcleo. Entre el núcleo y los electrones no existe
materia. Hay vacío.
Si aceptamos este modelo los
resultados del experimento de Rutherford pueden
explicarse fácilmente:
-
La mayor parte de las partículas
alfa traviesan los átomos sin desviarse (línea verde),
ya que la mayor parte del volumen del átomo es
espacio vacío.
-
Si la partícula incidente pasa
cerca del núcleo (lo cual es poco probable, ya que
el tamaño del núcleo es 10.000 veces menor que el
del átomo) es repelida por éste (línea azul),
-
Habrá un pequeño porcentaje de
partículas que choquen directamente con el núcleo
(probabilidad muy baja dada la pequeñez del
núcleo),
produciéndose un rebote.
|
 |
|