|
Una reacción muy indicada
para mostrar dicho principio es el
equilibrio que se establece entre el catión
hexaacuacobalto(II), que se forma cuando
una sal de cobalto(II) se disuelve en agua,
y el anión tetraclorurocobalto(II).
En el primero el número de
coordinación del cobalto es seis y tiene
una coloración rosada, mientras que en el
segundo el cobalto tiene un índice de
coordinación cuatro y presenta un color
azul fuerte característico (azul cobalto):
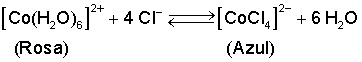
A temperatura ambiente el
equilibrio se encuentra desplazado hacia la
izquierda y la disolución presenta un color
rosado intenso.
Si añadimos cloruro, o
calentamos, el equilibrio se desplazará
hacia la derecha (el Cl- se
consume para formar el complejo y en ese
sentido la reacción es endotérmica).
Si tratamos de añadir iones
cloruro disolviendo cloruro de sodio, ocurre
que la disolución se satura antes de que el
cambio de color sea apreciable. |