|
El metal debe ser aluminio, ya que el valor
obtenido para el calor específico (0,197 cal/g 0C) está
bastante cerca del valor tabulado para este metal (0,217 cal/g 0C).
El error cometido, no obstante, es considerable:
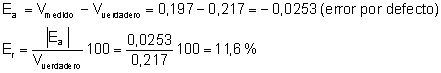
El resultado puede mejorarse considerando
el equivalente en agua del calorímetro.
Aunque no lo hemos considerado, el
calorímetro, el agitador o el termómetro, absorben cierta cantidad de
calor que, en consecuencia, no se emplea en calentar el agua. Puede
tenerse esto en cuenta calculando la masa de agua que absorbería el mismo
calor e incrementar la masa de agua en esa cantidad. Esta masa de agua
es el equivalente en agua del calorímetro.
En la experiencia anterior se ha calculado
experimentalmente el equivalente en agua del calorímetro encontrándose un
valor: k = 42, 5 g.
Repitamos el cálculo introduciendo ahora el equivalente
en agua del calorímetro: |