|
|

Apuntes (doc) |
| |
En la antigua Grecia dos
concepciones compitieron por dar una interpretación
racional a cómo estaba formada la materia: |
| |
|

Demócrito
(460-370 a.C) |
Demócrito
consideraba que la
materia estaba formada por pequeñas partículas
indivisibles, llamadas átomos. Entre los
átomos existe
vacío.
En palabras de Demócrito:
"Aparte de átomos y espacio vacío nada existe; lo
demás es opinión".
Los átomos de cada sustancia son
diferentes. Esa diferencia es la responsables de las
distintas propiedades observadas.
El atomismo, aunque no gozó de gran
aceptación, siempre tuvo seguidores. Lucrecio (95-55
a.C) recogió la teoría atomista en el poema De
Rerum Natura ("Sobre la naturaleza de las cosas"),
uno de los primeros textos impresos tras la invención
de la imprenta (s. XV), lo que permitió la difusión de
la idea atomista por Europa. |
|

Aristóteles
(384-322 a.C) |
Aristóteles
era partidario de la teoría de los cuatro elementos,
según la cual toda la materia estaría formada por la
combinación de cuatro elementos: fuego, aire, tierra y
agua.
Las distintas propiedades que se pueden
observar en las sustancias se deben a que los cuatro
elementos se combinan en distintas proporciones.
El oro, considerado el metal perfecto
(símbolo del Sol, resistente a la oxidación, insoluble
en los ácidos entonces conocidos... ), debería de
contener los cuatro elementos combinados en la
proporción ideal.
Los demás metales podrían transmutarse
en oro alterando las proporciones de los cuatro
elementos, sólo habría que idear un procedimiento para
hacerlo. |
|
La teoría de los
cuatro elementos fue la aceptada durante muchos
siglos. Siguiendo la teoría aristotélica los
alquimistas (que están considerados como los
primitivos químicos) intentaban obtener la Piedra
Filosofal, sustancia que les permitiría transmutar los
metales en oro, curar cualquier enfermedad y
evitar, incluso, la vejez y la muerte.
Su incesante
trabajo en el laboratorio dio como fruto la
invención o perfeccionamiento de muchos
procedimientos aún hoy usados en los laboratorios
(entre ellos la destilación), la síntesis de
numerosos compuestos (ácido clorhídrico,
sulfúrico o nítrico), el descubrimiento de
técnicas metalúrgicas, la producción de tintes,
pinturas o cosméticos… etc. |
 |
|
|

John Dalton
(1766-1844) |
En 1808 John Dalton
(1766-1844) recupera la teoría atómica de Demócrito y considera
que los átomos (partículas indivisibles) eran los
constituyentes últimos de la materia que se combinaban
para formar los compuestos.
La teoría atómica de Dalton no fue
aceptada por la comunidad científica hasta cerca de
cien años después. Durante todo el s. XIX compitió con
otra que explicaba las reacciones químicas basándose
en los llamados "pesos equivalentes" de las
sustancias.
La resistencia a aceptar la existencia
de los átomos y las moléculas (imposible de demostrar
en aquel tiempo) fue muy fuerte: " Los átomos son
aún más increíbles que el flogisto [...] La teoría
atómica no tiene ninguna base experimental (Mills,
1871)
|
|
|
| |

J.
J. Thomson
(1856-1940) |
Al final del s. XIX los
experimentos realizados sobre la conducción de la
electricidad por los gases, dieron como resultado el
descubrimiento de una extraña luz que procedente del
polo negativo, o cátodo (de ahí el nombre de "rayos
catódicos"), llenaba los tubos cuando eran
sometidos a voltajes elevados.
Diversos experimentos
revelaron que la naturaleza de esa luz era muy
distinta a la del sol. Thomson demostró en 1897
que estaba formada por pequeñas partículas con masa y
carga negativa que fueron bautizadas con el nombre de
electrones.
Los electrones saltan de los
átomos del gas que llena el tubo cuando es sometido a
descargas eléctricas. Los átomos, por tanto, no
eran indivisibles.
|
|
Más
información sobre rayos catódicos en FQW |
|
|
|
|
| |
|
J.J. Thomson
propone entonces el primer modelo de átomo:
Los electrones
(pequeñas partículas con carga negativa, en verde en
el dibujo) se encuentran incrustados en una nube de
carga positiva (fondo azul). La carga positiva de la
nube compensa exactamente la negativa de los
electrones siendo el átomo eléctricamente neutro.
El modelo de Thomson fue el primer
modelo de átomo compuesto. |
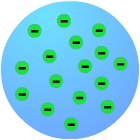
Modelo
atómico
de Thomson |
|
| |
|
|
|