|
El modelo de átomo planetario propuesto por Rutherford
mostró pronto algunos inconvenientes teóricos que lo
hacían inviable:
-
Contradecía la teoría electromagnética de Maxwell.
Según esta teoría una carga eléctrica acelerada
debería de emitir ondas electromagnéticas. Un
electrón al girar en círculos alrededor del núcleo
debería emitir, por tanto, ondas electromagnéticas.
Dicha emisión provocaría una pérdida de energía que
haría que el electrón describiera
órbitas
de radio decreciente hasta caer sobre el núcleo. El
modelo atómico de Rutherford era, por tanto,
inviable desde el punto de vista de la física
clásica.
-
No daba una explicación satisfactoria a los
espectros atómicos.
Si encerramos en un tubo hidrógeno o helio y
sometemos el gas a voltajes elevados, el gas emite
luz. Si hacemos pasar esa luz a través de un prisma,
los colores que la constituyen se separan dándonos
el espectro de la luz analizada (ver animación).
|
Los
navegadores han dejado de soportar Flash,
por tanto, puedes tener problemas para ver este tipo de
archivos ¿Qué hacer?
Otra
opción es reproducir
los archivos .swf
en local
(en tu propio ordenador) utilizando
el visor de Flash Player .
Existen visores para Windows, Mac y Linux. Haciendo
clic
aquí
encontrarás
las instrucciones para hacerlo.
Archivo .swf:
https://bit.ly/3azASfm |
|
|
|
 James Clerk
Maxwell (1831-1879) |
Pronto se concluyó que la emisión de luz podría deberse a que
los electrones absorbían energía de la corriente eléctrica y
saltaban a órbitas superiores para, a continuación, volver a
caer a las órbitas más próximas al núcleo emitiendo el exceso
de energía en forma de energía luminosa.
Esta interpretación conducía, sin embargo, a afirmar que los
espectros deberían de ser continuos, ya que al existir órbitas
de cualquier radio (y energía) todos los saltos son posibles.
La experiencia, por el contrario, mostraba que los espectros
de los átomos son discontinuos. Constan de rayas de diversos
colores sobre un fondo negro (ver imagen).
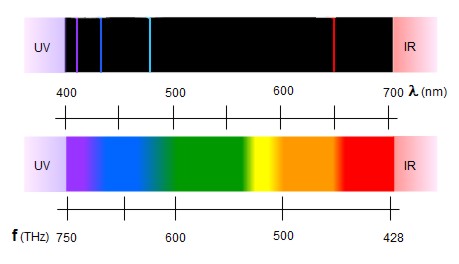
Arriba: espectro del hidrógeno (discontinuo)
Abajo: espectro de la luz solar (continuo) |