|
El Premio Nobel de Química 2019 se otorga a John B.
Goodenough, M. Stanley Whittingham y Akira Yoshino por
sus contribuciones al desarrollo de la batería de iones de
litio. Esta batería recargable sentó las bases de la
electrónica inalámbrica: teléfonos móviles y ordenadores
portátiles. También hace posible un mundo libre de
combustibles fósiles, ya que se utiliza para todo, desde
alimentar automóviles eléctricos hasta almacenar energía
de fuentes renovables |
|
Un elemento químico rara vez
desempeña un papel central, pero la historia del Premio
Nobel de Química de 2019 tiene un claro protagonista: el
litio, un elemento que se creó durante los primeros
minutos del Big Bang.
Berzelius dio nombre al
nuevo elemento derivándolo de la palabra griega “litos”
(piedra). A pesar de su nombre, es el elemento sólido más
ligero, lo cual es una buena noticia para todos los que
usamos teléfonos móviles.
La debilidad del litio, su
gran reactividad, es también su fortaleza. A principios de
la década de 1970, Stanley Whittingham
utilizó la enorme facilidad con la que el litio pierde su
electrón para desarrollar la primera batería de litio. En
1980, John Goodenough duplicó el potencial
de la batería, creando las condiciones adecuadas para una
batería mucho más potente y útil. En 1985, Akira
Yoshino logró eliminar el litio puro de la
batería, utilizando únicamente iones litio, más seguros
que el litio puro.
Las baterías de iones litio
han aportado grandes beneficios a la humanidad, ya que han
permitido el desarrollo de ordenadores portátiles,
teléfonos móviles, vehículos eléctricos y el
almacenamiento de la energía generada por la energía solar
y eólica.
Retrocederemos cincuenta
años en el tiempo, hasta el comienzo de la historia de la
batería de iones litio. |
|
|
A mediados del siglo XX, el
número de automóviles a gasolina aumentó
significativamente y los gases de sus motores empeoraron
el dañino smog en las grandes ciudades. Esto unido a la
evidencia de que el petróleo es un recurso finito, activó
las alarmas, tanto en los fabricantes de vehículos como en
las compañías petroleras. Necesitaban invertir en
vehículos eléctricos y fuentes alternativas de energía
para que sus negocios sobrevivieran.
Los vehículos eléctricos y
las fuentes alternativas de energía requieren baterías
potentes capaces de almacenar grandes cantidades de
energía. En este momento solo había dos tipos de baterías
recargables en el mercado: la pesada batería de plomo, que
se había inventado en 1859 (y que todavía se usa como
batería de arranque en automóviles de gasolina), y la
batería de níquel-cadmio que se desarrolló en la primera
mitad del siglo XX.
|
|
La amenaza del
agotamiento del petróleo motivó que un gigante
petrolero, Exxon, se decidiera a diversificar sus
actividades. Haciendo una importante inversión en
investigación básica, reclutaron a algunos de los
investigadores más importantes en el campo de la
energía y les dieron prácticamente una libertad total
con la única condición de que no involucraran al
petróleo en sus investigaciones.
Stanley
Whittingham fue uno de los que se mudaron a
Exxon en 1972. Venía de la Universidad de Stanford,
donde había investigado con materiales sólidos con
espacios del tamaño de un átomo en los que se pueden
introducir iones cargados. Las propiedades de los
materiales cambian cuando los iones se intercalan en
su interior. En Exxon, Stanley Whittingham y sus
colegas comenzaron a investigar materiales
superconductores, como el disulfuro de tántalo, en los
que se puede intercalar iones. Agregaron iones al
disulfuro de tántalo y estudiaron cómo afectaba a su
conductividad
|
|
Resultó que los iones de
potasio afectaban la conductividad del disulfuro de
tántalo. Estudios más detallados mostraron que
proporcionaba una densidad de energía muy alta. Las
interacciones entre los iones de potasio y el
disulfuro de tántalo eran sorprendentemente ricas en
energía y cuando se midió el voltaje del material,
obtuvieron un par de voltios, mejor que el
proporcionado por muchas de las baterías de esa época.
Sin embargo, el tántalo es un elemento pesado y el
mercado no demandaba baterías pesadas, por lo que
cambió el tántalo por titanio, un elemento que tiene
propiedades similares pero mucho más liviano.
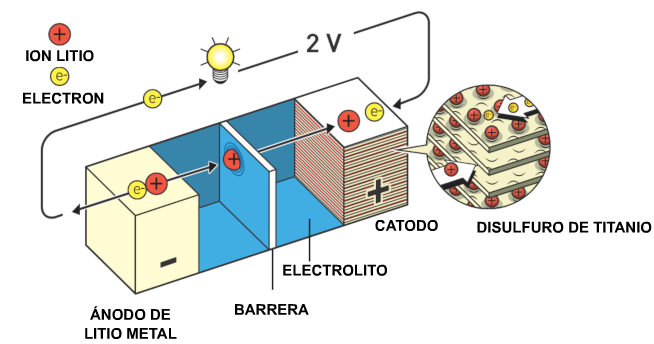
Aquí es donde el litio
entra en la historia. En una batería los electrones
deben fluir desde el electrodo negativo, el ánodo, al
positivo, el cátodo. Por lo tanto, el ánodo debe
contener un material que ceda fácilmente sus
electrones y, de todos los elementos, el litio es el
que libera electrones con mayor facilidad.
El resultado fue una
batería de litio recargable que funcionaba a
temperatura ambiente y - literalmente- tenía un gran
potencial.
Exxon decidió
desarrollar una batería comercialmente viable
utilizando el descubrimiento de Whittingham.
 |
|
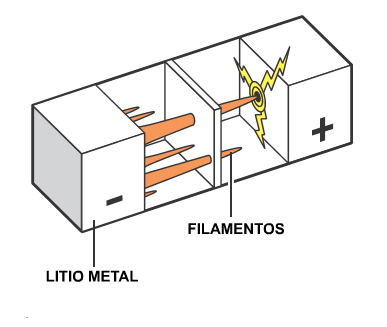
Desafortunadamente
surgieron algunos contratiempos. A medida que la
batería se recargaba, en el electrodo de litio
crecían finos hilos que cuando alcanzaban el otro
electrodo producían cortocircuitos que podían provocar
una explosión.
Para hacer la batería
más segura se añadió aluminio al electrodo de litio
metálico y se cambió el electrolito.. Stanley
Whittingham anunció su descubrimiento en 1976 y la
batería comenzó a fabricarse a pequeña escala para un
relojero suizo que quería usarla en unos nuevos
relojes
El siguiente objetivo
era escalar la batería de litio recargable para poder
alimentar un automóvil, pero el precio del petróleo
cayó espectacularmente a principios de la década de
1980 y Exxon necesitaba hacer recortes. El desarrollo
se suspendió y la tecnología de baterías de
Whittingham se licenció a tres compañías diferentes en
tres partes diferentes del mundo. Sin embargo esto no
significaba que el desarrollo se detuviera. Cuando
Exxon se rindió, John Goodenough se hizo cargo. |
 |
|
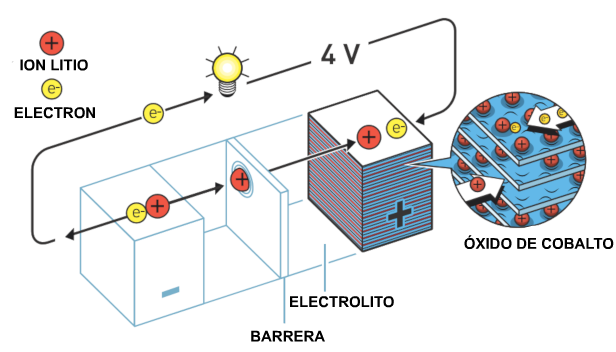
John Goodenough conocía
la revolucionaria batería de Whittingham, pero su
conocimiento del mundo atómico le decía que podrían
obtenerse mayores potenciales si el cátodo se
construyera utilizando un óxido de en lugar de un
sulfuro. Algunas personas de su grupo de investigación
se encargaron de encontrar un óxido de metal que
produjera un alto voltaje al intercalar iones de
litio, pero que no colapsara cuando se eliminaran los
iones.
La búsqueda fue más
exitosa de lo que John
Goodenough
se habría atrevido a esperar. La batería de
Whittingham generó más de dos voltios, pero Goodenough
descubrió que la batería con óxido de litio-cobalto en
el cátodo era casi el doble de potente, daba cuatro
voltios. En 1980, publicó el descubrimiento de este
nuevo material de cátodo de alta densidad energética
que, a pesar de su bajo peso, dio como resultado
baterías potentes de alta capacidad. Este fue un paso
decisivo hacia la revolución inalámbrica.
|
|
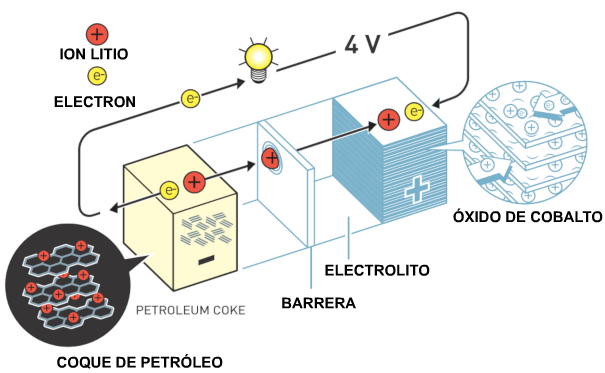
Cuando Akira Yoshino
decidió desarrollar una batería recargable se
utilizaba el óxido de litio-cobalto de Goodenough como
cátodo y él probó varios materiales a base de carbono
como ánodo. Los investigadores habían demostrado
previamente que los iones litio podrían intercalarse
entre las capas moleculares del grafito, pero el
electrolito de la batería descompuso el grafito. El
momento eureka de Akira Yoshino llegó cuando intentó
usar coque de petróleo, un subproducto de la industria
petrolera. Cuando cargó el coque de petróleo con
electrones, los iones litio se introdujeron en el
material. Luego, cuando encendió la batería, los
electrones y los iones de litio fluyeron hacia el
óxido de cobalto en el cátodo, que tiene un potencial
mucho mayor.
La batería desarrollada
por Akira Yoshino es estable, liviana, tiene una gran
capacidad y produce cuatro voltios.
La mayor ventaja
de la batería de iones litio (Li-ion) es que los iones
están ocluidos en los electrodos. La mayoría de las
baterías se basan en reacciones químicas en las que
los electrodos terminan deteriorándose y deben ser
cambiados. Cuando se carga o usa una batería de iones
de litio los iones fluyen entre los electrodos sin
reaccionar con su entorno. Esto significa que la
batería tiene una larga vida útil y puede cargarse
cientos de veces antes de que se deteriore. |
|
 |
|
Otra gran ventaja es que
la batería no tiene litio puro. En 1986, cuando Akira
Yoshino estaba comprobando la seguridad de la batería,
por precaución, utilizó una instalación diseñada para
probar dispositivos explosivos. Dejó caer un trozo de
hierro sobre la batería y no pasó nada. Sin embargo al
repetir el experimento con una batería que contenía
litio puro hubo una explosión violenta.
Pasar las pruebas de
seguridad fue fundamental para el futuro de la
batería. Akira Yoshino dice que este fue el momento en
que nació la batería de iones litio. |
|
Como es natural la
producción de baterías Li-ion tiene un impacto en el
medio ambiente, pero también tiene enormes beneficios
ambientales. Ha permitido el desarrollo de tecnologías
de energía más limpia y vehículos eléctricos,
contribuyendo así a reducir las emisiones de gases de
efecto invernadero y partículas.
A través de su trabajo,
Stanley Whittingham, John Goodenough y Akira
Yoshino han creado las condiciones adecuadas
para una sociedad inalámbrica y libre de combustibles
fósiles, un gran beneficio para la humanidad.
|
|
|