|
Eric
Betzig, Stefan W. Hell y William E. Moerner
han obtenido el Premio Nobel de Química 2014 por haber
superado la limitación que establecía que un microscopio
óptico nunca puede tener una resolución mayor de 0,2
micrómetros. Utilizando la fluorescencia de las moléculas
los científicos pueden ahora controlar la interacción
entre moléculas individuales en el interior de las
células, observar las proteínas relacionadas con
determinadas enfermedades o rastrear la división celular a
una escala de nanómetros. |
|
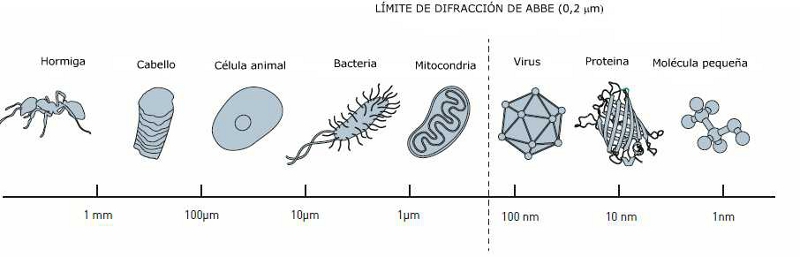
Durante mucho
tiempo la microscopía óptica estuvo limitada por una
limitación física en cuanto al tamaño de las estructuras
que era posible observar. En 1873 el microscopista Ernst
Abbe demostró que la resolución de un microscopio está
limitada por, entre otras cosas, la longitud de onda de la
luz empleada. Durante la mayor parte del siglo XX esto
llevó a creer que los microscopios ópticos nunca serían
capaces de observar cosas más pequeñas que,
aproximadamente, la mitad de la longitud de onda de la
luz, es decir, 0,2 micrómetros (Figura 1). Podríamos
observar los contornos de algunos orgánulos de las
células, como las mitocondrias, pero sería imposible
distinguir objetos más pequeños o, por ejemplo, seguir la
interacción entre moléculas de proteínas en la célula. Es
algo parecido a ser capaz de ver los edificios de una
ciudad sin ser capaz de observar a sus ciudadanos ni saber
cómo viven.
|
Stefan
Hell trabajó en la llamada microscopía de
fluorescencia, una técnica en la que se usan moléculas
fluorescentes para obtener imágenes del interior de la
célula. Por ejemplo, se pueden utilizar anticuerpos
fluorescentes que se acoplan específicamente al ADN
celular y que después se excitan mediante un breve pulso
de luz, haciéndolos brillar durante unos instantes. Si los
anticuerpos se acoplan al ADN emitirán luz desde el
interior de la célula, ya que el ADN se localiza en su
núcleo. De esta manera los científicos pueden ver donde se
localizan ciertas moléculas. Pero sólo fueron capaces de
localizar grupos de moléculas enredadas en los filamentos
del ADN. La resolución es demasiado baja para discernir
las cadenas de ADN individuales. Era como ver un rollo de
hilo, pero no el hilo.
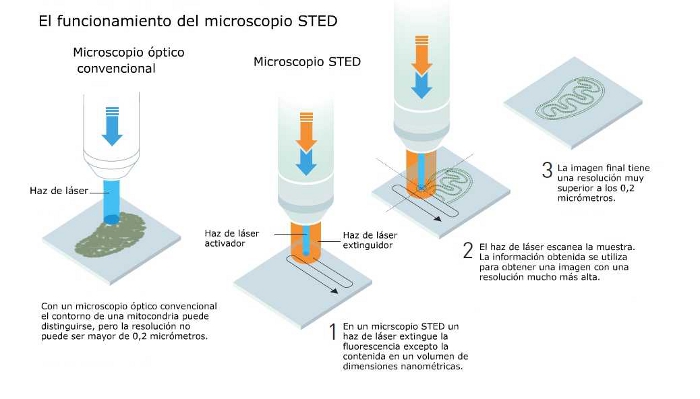
Cuando Stefan
Hell descubrió el fenómeno de la emisión estimulada, se
dio cuenta de que podía ser posible idear una especie de
nanolinterna capaz de barrer la muestra, nanómetro a
nanómetro, y usando la emisión estimulada apagar las
moléculas fluorescentes. Al incidir el láser en las
moléculas perderían su energía oscureciéndose. En el
método propuesto, denominado disminución de la emisión
estimulada (STED), un pulso de luz excita las moléculas
fluorescentes, mientras que otro pulso de luz la anula,
excepto en un volumen de tamaño nanómetrico, en el centro
del haz. Sólo este volumen es visible. Barriendo la
muestra y midiendo continuamente los niveles de luz, es
posible obtener una imagen completa. Cuanto menor sea el
volumen que emite fluorescencia en determinado momento,
tanto mayor será la resolución de la imagen final. Por lo
tanto, en principio, no existe límite a la resolución de
los microscopios ópticos. El microscopio STED recoge la
luz de una multitud de pequeños volúmenes para crear un
conjunto
En contraste,
el segundo trabajo premiado, la microscopía de un sola
molécula, implica la superposición de varias imágenes.
Eric Betzig y W. E. Moerner,
independientemente, contribuyeron a su desarrollo.
En
1989 W. E. Moerner consiguió un logro
fundamental al ser capaz de medir la absorción de la luz
por una sola molécula por primera vez. El experimento
abrió la puerta a un futuro nuevo e inspiró a muchos
químicos a dirigir su atención hacia las moléculas
individuales. Uno de ellos fue Eric Betzig
Ocho años más
tarde Moerner dio el siguiente paso hacia la microscopía
unimolecular, apoyándose en el descubrimiento de la
proteína fluorescente GFP. Descubrió que la
fluorescencia de una variante de la GFP podía encenderse
y apagarse a voluntad. Cuando excitó la proteína con luz
de longitud de onda de 488 nm la proteína comenzó a emitir
fluorescencia, pero después de un rato se apagó. Luego,
con independencia de la cantidad de luz que incidiera
sobre la proteína, la fluorescencia no apareció. Resultó,
sin embargo, que la luz de 405 nm podía hacer que la
fluorescencia volviera a aparecer. Una vez reactivada
volvía a emitir fluorescencia con luz de 488 nanómetros.
Con este experimento Moerner demostró que era posible
controlar ópticamente la fluorescencia de moléculas
individuales. |
|
|
El verdadero
avance llegó en 2005, cuando Eric Betzig se
tropezó con proteínas fluorescentes que podrían activarse
a voluntad, similares a las moléculas que W. E. Moerner
había detectado en 1997. Betzig se dio cuenta de que tal
proteína era la herramienta necesaria para implementar la
idea que había tenido diez años antes.
Un año más
tarde, Eric Betzig demostró, en colaboración con los
científicos que trabajan con proteínas fluorescentes, que
su idea podía ser llevada a la práctica. Entre otras
cosas, acoplaron la resplandeciente proteína a la
membrana que envuelve el lisosoma, la estación de
reciclaje de la célula. Usando un pulso de luz las
proteínas fueron activadas para que emitieran
fluorescencia, pero si el pulso era lo suficientemente
débil sólo una fracción de ellas comenzaba a brillar.
Debido a su reducido número, la distancia entre la mayoría
de ellas era superior a los 0,2 micrómetros, el límite de
difracción de Abbe.
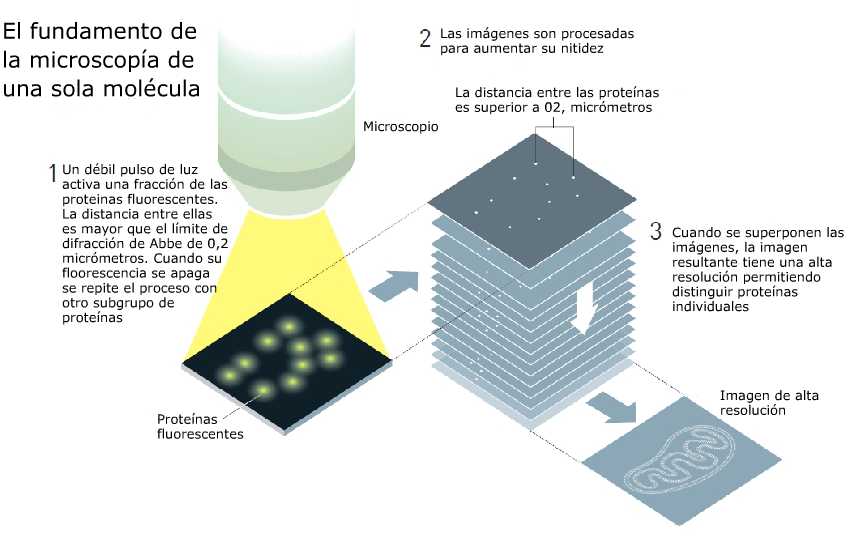
Por lo tanto,
la posición de cada proteína podía ser registrada con
mucha precisión con el microscopio. Después de un tiempo,
cuando la fluorescencia cesa, se activa un nuevo subgrupo
de proteínas. Una vez más, el pulso era tan débil que sólo
una fracción de las proteínas comienza a brillar, con lo
cual se registra otra imagen. Este procedimiento se repite
una y otra vez. Al superponer las imágenes, Betzig
obtuvo una imagen de alta resolución de la membrana del
lisosoma. Su resolución es mucho más alta que el límite de
difracción de Abbe. El innovador método fue publicado en
Science en 2006.
Los métodos
desarrollados por Eric Betzig, Stefan Hell y W. E. Moerner
han conducido a varias técnicas de nanoscopía y
actualmente se utilizan en todo el mundo. Los tres
galardonados son investigadores que siguen activos
encabezando la innovación en el campo de la nanoscopía.
Dirigiendo su poderoso nanoscopio hacia los componentes
más pequeños de la vida, generan conocimiento de
vanguardia. Stefan Hell se asoma al interior de las
células nerviosas, vivas, con el fin de comprender mejor
las sinapsis cerebrales. W el. E. Moerner ha estudiado las
proteínas en relación con la enfermedad de Huntington.
Eric Betzig ha rastreado la división celular dentro de los
embriones. Estos son solo algunos ejemplos. Una cosa es
cierta, el Premio Nobel de Química 2014 ha sentado las
bases del desarrollo de un conocimiento de gran
importancia para la humanidad.
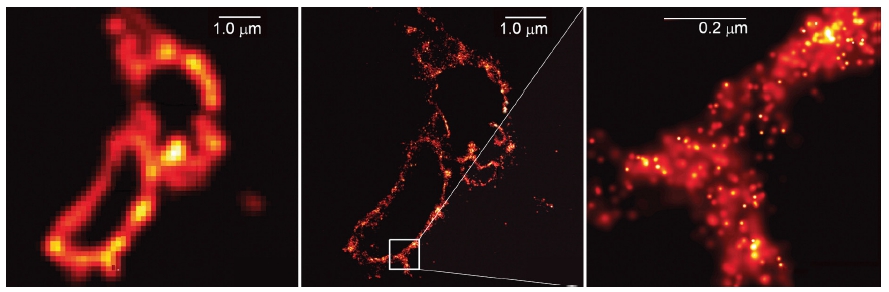
La imagen del
centro muestra las membranas del lisosoma y es una de las
primeras tomadas por Betzig utilizando microscopía de una
sola molécula. A la izquierda, la misma imagen tomada
mediante microscopía convencional. A la derecha se ha
ampliado la imagen de las membranas. Téngase en cuenta que
la escala de 0,2 micrómetros equivale al límite de
difracción de Abbe. La resolución es mucho mejor. Imagen
de Science 313:1642 – 1645.
|
|
|
|