|
El viraje del indicador
nos indica el punto final de la valoración. Esto es,
cuando todo el ácido ha sido neutralizado por la base. Cuando esto
suceda, y se agregue una sola gota de base en exceso, el pH alcanza
valores por encima de diez provocando el cambio de color del indicador
(ver imagen).
Conocido el volumen de base
empleado, y su concentración, podemos calcular los
moles de NaOH necesarios para neutralizar el ácido.
¿Qué indicador usar?
El indicador ha de seleccionarse teniendo en cuenta que
su intervalo de viraje esté
comprendido en la zona en la que se produce el salto de pH (zona
vertical en la gráfica), aunque cuanto más cercano esté el
intervalo de viraje al punto de equivalencia mejor se apreciará el
punto final de la valoración.
En este caso el salto de pH se produce entre pH 6,0 y
12,0, y el punto
de equivalencia para el CH3COOH es de 8,7, ya que la
sal formada (NaCH3COO) es una sal procedente de un ácido
débil y experimenta una hidrólisis básica. |

La aparición de un color violeta persistente, debido al
viraje del indicador, nos indica el punto final de la valoración. |
|
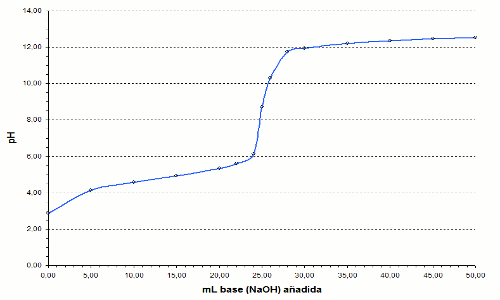
Grafica para la valoración de ácido
acético con NaOH |

Diversos indicadores ácido-base y colores en medio
ácido (arriba) y en medio básico (abajo).
De izquierda a derecha: fenolftaleína, rojo de metilo,
azul de bromotimol, naranja de metilo y rojo congo |