|
Conocido el volumen de
disolución de base añadida, y su concentración, podemos calcular los moles
de NaOH necesarios para neutralizar el ácido.
En esta ocasión (y como
media de las valoraciones efectuadas) se han gastado 10,5 mL de base.
Luego:
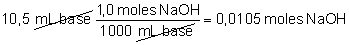
Como según la ecuación 1mol
de NaOH reacciona con 1 mol de ácido acético, tendremos 0,0105 moles de
ácido acético. Como esa cantidad estaba en un volumen de 10,0 mL de
vinagre la molaridad del vinagre será:
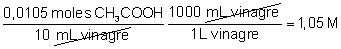
La concentración en g/L:
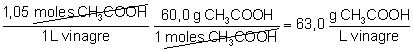 |
 |
|
Para calcular la
concentración en % en masa necesitamos saber la densidad del vinagre. Como
la densidad del ácido acético puro es muy aproximadamente 1,0 g/mL (1,05
g/mL) podemos considerar que la densidad de la disolución es 1,0 g/mL. Por
tanto:
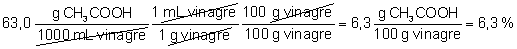
La etiqueta del vinagre
indica que el grado de acidez del mismo es de 60. Esto es, que
la concentración en tanto por ciento en volumen de la disolución
es del 6%. Según la valoración efectuada, y teniendo en cuenta que la
densidad del ácido acético se 1,05 g/mL, el tanto por ciento en volumen
(grado de acidez) será:
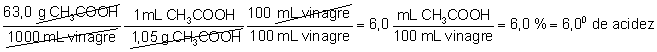 |
 |