|
La solubilidad de una sustancia es un proceso complejo en el que intervienen diferentes factores:
Para que una sustancia se disuelva la energía de Gibbs
correspondiente al proceso de disolución ha de ser negativa:
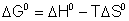
Así podemos justificar que procesos endotérmicos
(disolución del KNO3 o de sales de amonio) sean posibles, ya
que en los procesos de disolución de los compuestos iónicos el paso de
soluto sólido a disuelto lleva consigo un aumento de entropía
considerable, que hace que la variación de la energía de Gibbs
correspondiente al proceso resulte negativa.
Como norma general:
-
Los compuestos iónicos tienen tendencia a ser solubles en
agua y disolventes polares (salvo que su energía de red sea elevada).
-
Las sustancias covalentes polares son solubles en agua.
-
Las sustancias covalentes no polares tienden a disolverse
en disolventes no polares.
|
|

Yodo, dicromato de potasio |
|

Permanganato de potasio |
|