|
Una forma de retirar iones Fe3+ es precipitándolos.
El Fe3+ se puede precipitar como Fe(OH)3
,un sólido color anaranjado. Tras adicionar el NaOH a
la disolución (foto de la izquierda) se forman en pocos segundos los
primeros copos de precipitado que, poco a poco, van creciendo y
depositándose en el fondo. Al retirar de la disolución los iones Fe3+
el equilibrio se desplaza en el sentido de generar esos iones, lo que
se logrará haciendo que el complejo se descomponga y el equilibrio se
desplace hacia la izquierda. El color rojizo se perderá y aparecerá el
amarillo del ión Fe3+ que puede observarse en el líquido
sobrenadante.
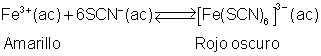
|

| Adición de hidróxido
de sodio (vaso de la izquierda). El de la derecha es
el testigo. |
Precipitado de Fe(OH)3 en el fondo del
vaso central y el situado a la izquierda. El líquido sobrenadante
es amarillo (Fe3+). |
|
|
Dejando uno
de los vasos como testigo (el del centro), si ahora añadimos HCl(ac) disolveremos el Fe(OH)3 haciendo que los iones Fe3+
regresen nuevamente a la disolución, lo que provocará que el
equilibrio se desplace ahora hacia la derecha. La disolución vuelve a
tomar un color rojizo.
El resultado
de la adición de HCl al tercer vaso (situado más a la izquierda),
se puede ver en la imagen de la derecha. En el centro se ha dejado
como testigo el vaso con el precipitado de trihidróxido de hierro. A
la derecha el aspecto inicial de la disolución. |

|
Adición de ácido clorhídrico (1,0
M) (con el fin de disolver el precipitado de Fe(OH)3. |
Izquierda, después de añadir HCl. Centro,
precipitado de Fe(OH)3. El líquido es amarillo (Fe3+). Derecha, disolución original. |
|
|
El SCN-
puede retirarse de la disolución añadiendo iones Hg2+ procedentes del
dicloruro de mercurio, ya que se forma el complejo [Hg(SCN)4]2-.
El dicloruro de mercurio no es soluble en
agua, pero al revolver se forma el complejo y el
equilibrio se desplaza hacia la izquierda (imagen de la izquierda).
Otra manera
de retirar el Fe3+ es añadiendo aniones fosfato que forman
un quelato con el hierro(III), retirándolo de la disolución. El equilibrio vuelve a desplazarse
hacia la izquierda tomando una tonalidad amarilla. Foto de la derecha. |

|
Desplazamiento del equilibrio por adición de iones Hg2+. |
Desplazamiento del equilibrio por adición de iones
PO43-. |
|