|
En la imagen se muestra el resultado de calentar (vaso
de la izquierda) y enfriar (vaso del centro).
Como se puede observar la disolución toma un color
amarillo al calentar, indicativo de que el equilibrio se desplaza
hacia la izquierda, por lo que deducimos que la reacción de
descomposición del complejo en sus iones es una reacción endotérmica.
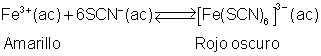
Al enfriar la disolución adquiere un tono rojizo,
indicativo de que el equilibrio se desplaza ahora hacia la derecha. La
reacción de formación del complejo es exotérmica
|

|
Izquierda: la disolución se ha calentado.
Centro: la disolución se ha enfriado.
Derecha: testigo. Color original |
|