|
|
|
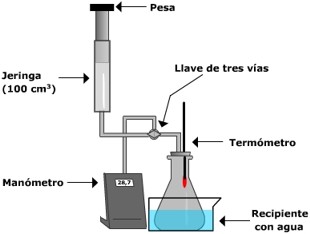
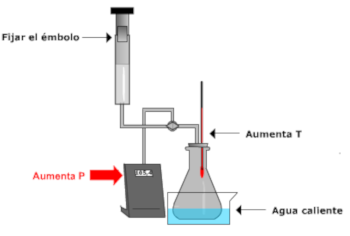
El estudio experimental de
las leyes de los gases se puede realizar en
el laboratorio con un montaje tal como el
que se muestra:
 |

Clic en la imagen para ver
el vídeo |
|
En el vídeo se puede ver la
manera de reproducir procesos isotermos (T=cte);
procesos isobaros (P=cte), manteniendo el
émbolo libre, o procesos isocoros (V=cte),
bloqueando el émbolo con cinta adhesiva
En los procesos a volumen
constante o a presión constante, se modifica
la temperatura del aire contenido en el
matraz erlenmeyer sumergiéndolo en agua
(fría o caliente) |
|
Leyes de los gases.
Animaciones |
|
|
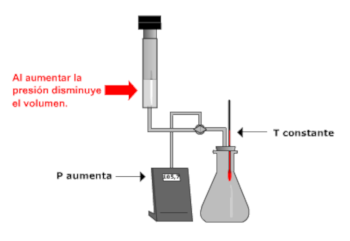 |
Procesos
isotermos (T = cte). Ley de Boyle- Mariotte.
|
 |
 |
|
Robert Boyle
(1627 – 1691) |
Edme Mariotte
(1620 – 1684) |
Si
consideramos una cantidad dada de gas y
aumentamos la presión (manteniendo constante
la temperatura), su volumen disminuye. Si
por el contrario disminuimos la presión, su
volumen aumenta.
P y V son magnitudes
inversamente proporcionales. Esto es, su
producto permanece invariable.
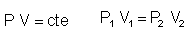 |
|
|
|
|
|
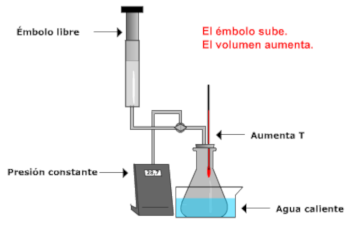 |
Procesos
isobaros (P = cte). Ley de Charles
|
 |
|
Jacques Charles
(1746 – 1823) |
Si
consideramos una cantidad dada de gas y
aumentamos su temperatura (manteniendo
constante la presión), su volumen aumenta.
Si por el contrario disminuimos la
temperatura, su volumen disminuye.
V y T son directamente
proporcionales. Esto es, el cociente de
valores correspondientes de V y T, permanece
invariable.
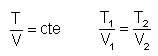 |
|
|
|
|
|
 |
Procesos
isocoros (V = cte). Ley de Gay-Lussac
|
 |
|
Louis
J. Gay-Lussac
(1778 –
1850) |
Si
consideramos una cantidad dada de gas y
aumentamos su temperatura (manteniendo
constante el volumen), su presión aumenta.
Si por el contrario disminuimos la
temperatura, su presión disminuye.
P y T son directamente
proporcionales. Esto es, el cociente de
valores correspondientes de P y T, permanece
invariable.
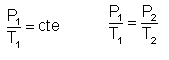 |
|