|
|
|
|
|
Átomos y enlaces |
|
Los elementos químicos tratan de adquirir
una configuración electrónica que sea estable.
En la mayoría de los casos esa estabilidad está ligada a
que su última capa (capa de valencia) posea la
configuración de gas noble (ns2p6).
Para adquirirla los elementos se combinan con otros con el
fin de obtener los electrones que les faltan, o
desprenderse de los que tienen “en exceso”. La manera de
lograr esto da lugar a los distintos tipos de enlace
existentes:
|
|
Transferencia electrónica. Enlace iónico.
Cuando un átomo muy electronegativo (que
tiene una gran avidez por los electrones: no metal,
situado a la derecha del S.P, con una estructura
electrónica próxima a la de gas noble) se
enfrenta a un átomo poco electronegativo (que
tiende a desprenderse de los electrones: metal,
situado a la izquierda o en la parte central del S.P) se
produce una “coincidencia de intereses”. El átomo
electronegativo (p. ej. el Cl), necesita tomar un
electrón, mientras que el menos electronegativo (p.
ej. el Na) lo que necesita es desprenderse de uno. Por
esta razón se produce la transferencia
de un electrón del sodio (que lo pierde,
transformándose en un ión positivo) al cloro (que lo
gana, transformándose en un ión negativo). Como
consecuencia, aparecen iones de carga opuesta que se
atraerán. Como esta atracción electrostática
actúa en todas direcciones, cada ión negativo se
rodeará del mayor número posible de iones de signo
positivo, y éstos de iones negativos, formándose una
estructura llamada macromolécula o cristal,
cuyas unidades estructurales son iones de signo
opuesto. |
|
 |
|
La transferencia electrónica de uno o más
electrones para formar iones es el proceso
fundamental del enlace iónico |
|
|
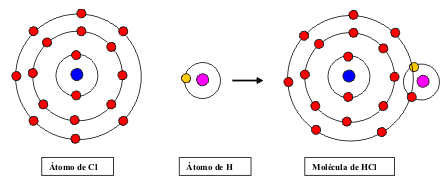
Compartición de electrones. Enlace
covalente.
Si los átomos que consideramos son
ambos electronegativos (no metales), ocurrirá que
ninguno de los dos tenderá a ceder electrones, no
pudiendo, en consecuencia, enlazarse mediante enlace
iónico.
En este caso la solución que se adopta es
mantenerse juntos (unidos) con el fin de compartir
pares de electrones, de forma tal, que todos
los átomos enlazados adquieran una configuración
electrónica estable. |
|
 |
|
Teóricamente en un enlace covalente los
pares de electrones deberían compartirse de manera
rigurosa (al 50%). O lo que es lo mismo, si hiciéramos
“un reparto” dividiendo los electrones de enlace entre
los átomos enlazados, a cada uno de ellos debería
corresponderle uno de los dos electrones del par. Sin
embargo, esto sólo es cierto cuando los elementos que
se enlazan son exactamente iguales o de
electronegatividad muy parecida. En caso contrario, el
elemento más electronegativo “tira” más del par de
enlace quedándose con más del 50% que le
correspondería. Si ahora efectuamos una división del
par de enlace, al átomo más electronegativo le
correspondería (por ejemplo) el 80 %. De esta manera,
éste átomo “coge electrones” adquiriendo cierta carga
negativa (aunque no llega a ser de una unidad lo que
se correspondería con un enlace iónico), y el menos
electronegativo queda con cierta carga positiva.
Como se puede observar, y dependiendo del número de
electrones necesario para adquirir la deseada
estabilidad, los átomos se van a combinar en una u
otra proporción: Ejemplos: |
|
 |
| |
|
|
|