|
Muchas veces la formación de
enlaces requiere la realización de reacciones secundarias
que implican una costosa pérdida de materiales
En lugar de intentar unir
átomos de carbono con una baja tendencia a unirse,
Barry Sharpless sugirió comenzar con moléculas más
pequeñas. Estas moléculas simples podrían unirse entre sí
enlazándolas mediante átomos de nitrógeno o de oxígeno,
mucho más reactivos. Si se emplean reacciones simples,
donde ya hay un fuerte tendencia para que las moléculas se
unan, se evitan muchas de las reacciones secundarias, y el
consumo de reactivos es mínimo.
Llamó a este
método química clic. La combinación de
bloques de construcción químicos simples hace posible
crear una variedad casi infinita de moléculas, por lo que
estaba convencido de que podría generar productos
farmacéuticos que fueran tan útiles como los que se
encuentran en la naturaleza, y que podrían producirse a
escala industrial. Incluso cuando no puede proporcionar
copias exactas de moléculas naturales, será posible
encontrar moléculas que cumplan las mismas funciones
En su publicación
de 2001, Sharpless enumeró varios criterios que deberían
cumplirse para que una reacción química pueda ser
considerada química clic. Uno de ellos es que la reacción
debería tener lugar en presencia de oxígeno y en agua, que
es un solvente barato y respetuoso con el medio ambiente.
La
cicloadición azida-alquino catalizada por cobre
fue descubierta por Morten Medal en 2001.
Ese mismo año,
(independientemente de Morten Meldal), Barry Sharpless
también publicó un artículo sobre la reacción catalizada
por cobre entre azidas y alquinos, mostrando que la
reacción funciona en agua y es fiable. Lo describió como
una reacción clic "ideal". La azida es como un
resorte, cuya fuerza es liberada por el ion cobre.
Sharpless propuso usar la reacción para unir fácilmente
moléculas diferentes. Su potencial era enorme.
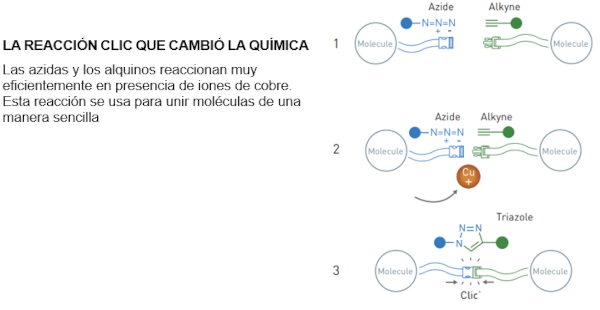
Si los químicos
necesitan unir dos moléculas diferentes podían hacerlo
ahora con relativa facilidad, introduciendo una azida en
una molécula y un alquino en la otra para unirlas luego
con la ayuda de los iones cobre.
Esta simplicidad ha llevado
a que la reacción se haya vuelto tremendamente popular,
tanto en los laboratorios de investigación como en el
desarrollo industrial. Entre otras cosas, las reacciones
clic facilitan la producción de nuevos materiales.
A principios de la
década de 1990, Carolyn Bertozzi comenzó a
estudiar un glicano que atrae las células inmunes a los
ganglios linfáticos. La falta de herramientas eficientes
implicó invertir cuatro años para entender cómo funcionaba
el glicano, lo que la hizo pensar en mejorar el método.
Durante un
seminario en Duringa, escuchó a un científico alemán
explicar cómo había logrado que las células produjeran una
variante no natural del ácido siálico, uno de los azúcares
que producen glicanos. Por lo tanto, Bertozzi comenzó a
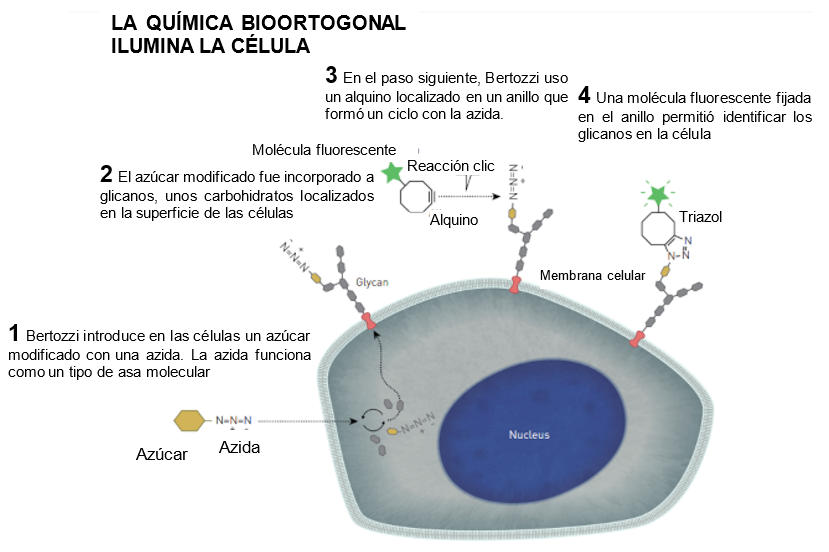
preguntarse si podría usar un método similar para que las
células produjeran un ácido siálico con una especie de asa
molecular en la que fijar otras moléculas. Si las células
pudieran incorporar el ácido siálico modificado en
glicanos, se podría incorporar un marcador para mapearlos.
Podría, por ejemplo, unirse una molécula fuorescente. La
luz emitida revelaría dónde se sitúan los glicanos en la
célula.
Fue el comienzo de
algo mucho más grande. Carolyn Bertozzi ha continuado
perfeccionando su reacción clic, por lo que funciona aún
mejor en entornos celulares. Paralelamente a esto, ella y
muchos otros investigadores también han utilizado estas
reacciones para explorar cómo interactúan las biomoléculas
en las células y para estudiar otros procesos.
Un área en la que
Bertozzi se centra son el estudio de los glicanos de las
células tumorales. Sus estudios han llevado a la idea de
que algunos glicanos parecen proteger a los tumores del
sistema inmunológico, ya que hacen que las células inmunes
dejen de funcionar. Para bloquear este mecanismo de
protección, Bertozzi y sus colegas han creado un nuevo
tipo de fármaco biológico. Han unido un anticuerpo
específico a las enzimas que descomponen los glicanos en
la superficie de las células tumorales. Este fármaco se
está probando actualmente en ensayos clínicos en personas
con cáncer avanzado.
Muchos investigadores
también han comenzado a desarrollar anticuerpos clicables
para los tumores. Una vez que los anticuerpos se adhieren
al tumor, se inyecta una segunda molécula que hace clic en
el anticuerpo. Por ejemplo, un radioisótopo que se puede
usar para rastrear tumores usando un escáner PET o que
puede dirigir una dosis letal de radiación a las células
cancerosas.
la química desarrollada por
Barry Sharpless, Carolyn Bertozzi y Morten
Meldal, además de ser elegante, inteligente,
novedosa y útil, también aporta un enorme beneficio a la
humanidad.
|