|
|
|
|

Jacques Dubochet
|

Joachim Frank
|

Richard Henderson |
"Por el desarrollo de la
microscopía crioelectrónica, empleada para la
determinación, con alta resolución, de estructuras de
biomoléculas en disolución."
Jacques Dubochet
(1942). Suiza.
Joachim Frank (1940).
Alemania.
Richard Henderson (1945).
Reino Unido.
 Documento
Fundación Nobel traducido
Documento
Fundación Nobel traducido
|
|
|
|
|
Jacques Dubochet, Joachim Frank y Richard Henderson
han recibido el Premio Nobel de Química 2017 por haber
desarrollado un método eficaz para generar imágenes
tridimensionales de las biomoléculas. Usando
microscopía crioelectrónica los investigadores pueden
ahora congelar biomoléculas en pleno movimiento y
fotografiarlas con resolución atómica. Esta tecnología ha
llevado a la bioquímica a una nueva era. |
|
|
Jacques
Dubochet, Joachim Frank y Richard Henderson han hecho
descubrimientos innovadores que han permitido el
desarrollo de la microscopía crioelectrónica (cryo-EM). El
método ha llevado a la bioquímica a una nueva era, ahora
es más fácil que nunca capturar imágenes de biomoléculas.
En la
primera mitad del siglo XX, las biomoléculas (proteínas,
ADN y ARN) eran terra incognita en el mapa de la
bioquímica. Los científicos sabían que desempeñaban
papeles fundamentales en la célula, pero no tenían idea de
su aspecto. Fue en la década de 1950 cuando los
investigadores de Cambridge comenzaron a exponer los
cristales de proteínas a rayos X, y observaron por primera
vez sus estructuras en espiral.
A
principios de la década de 1980 el uso de la
cristalografía de rayos X se complementó con el uso de la
espectroscopía de resonancia magnética nuclear (RMN) para
estudiar proteínas en estado sólido y en solución. Esta
técnica no solo revela su estructura, sino también cómo se
mueven e interactúan con otras moléculas.
Gracias a
estos dos métodos, ahora hay bases de datos que contienen
miles de modelos de biomoléculas que son utilizadas desde
la investigación básica hasta el desarrollo de fármacos.
Sin embargo ambos métodos tienen limitaciones
fundamentales. La RMN en solución solo funciona para
proteínas relativamente pequeñas. La cristalografía de
rayos X requiere que las moléculas formen cristales bien
organizados, como cuando el agua se congela formando
cristales de hielo. Las imágenes obtenidas son como las
antiguas fotografías en blanco y negro: imágenes estáticas
que revelan muy poco acerca de la dinámica de la proteína.
No
obstante, muchas moléculas no forman cristales, lo que
motivó que Richard Henderson abandonara la
cristalografía de rayos X en la década de 1970. Aquí
comienza la historia del Premio Nobel de Química de 2017.
Richard
Henderson hizo su doctorado en el grupo de cristalografía
de rayos X de Cambridge, Reino Unido. Usó el método para
obtener imágenes de proteínas, pero surgieron dificultades
cuando intentó cristalizar una proteína incrustada en la
membrana que rodea la célula.
Las
proteínas de membrana son difíciles de manejar. Cuando se
retiran de su entorno natural la membrana, a menudo, se
transforma en una masa amorfa
En
teoría, la resolución del microscopio electrónico era más
que adecuada para que Henderson obtuviera la estructura
atómica de una proteína de membrana, pero en la práctica
el proyecto era casi imposible. Cuando se inventó el
microscopio electrónico en la década de 1930, los
científicos pensaban utilizarlos para estudiar la materia
inanimada. El intenso haz de electrones, necesario para
obtener imágenes de alta resolución, destruye el material
biológico y, si el haz se debilita, la imagen pierde su
contraste y se vuelve borrosa.
Además,
el microscopio electrónico requiere trabajar en vacío,
pero en estas condiciones las biomoléculas se deterioran
porque el agua se evapora. Cuando las biomoléculas se
secan, pierden su estructura natural, haciendo inservibles
las imágenes.
Casi todo
indicaba que Richard Henderson fracasaría, pero el
proyecto se salvó gracias a la proteína que había elegido
estudiar: la bacteriorrodopsina.
En lugar
de eliminar la proteína sensible de la membrana, como
Richard Henderson había intentado anteriormente, tomaron
la membrana púrpura completa y la colocaron bajo el
microscopio electrónico. Cuando la proteína permaneció
rodeada por la membrana, conservó su estructura; además
cubrieron la superficie de la muestra con una solución de
glucosa que la protegía de la desecación cundo se hacía el
vacío. |
|
El
fuerte haz de electrones fue un problema importante,
pero los investigadores aprovecharon la forma de
empaquetarse las moléculas de bacteriorrodopsina en la
membrana. En lugar de utilizar un haz estándar
hicieron pasar un flujo más débil a través de la
muestra. El contraste de la imagen era pobre y no
podían ver las moléculas individuales, pero teniendo
en cuenta que las proteínas se empaquetaban y
orientaban regularmente en la misma dirección, todas
las proteínas difractan los haces de electrones de una
manera casi idéntica, lo que permitió calcular una
imagen más detallada basada en el patrón de difracción
que utilizaba un enfoque matemático similar al
utilizado en la cristalografía de rayos X.
En la
siguiente etapa, los investigadores giraron la
membrana bajo el microscopio electrónico, tomando
imágenes desde diferentes ángulos. De esta manera (en
1975) fue posible producir un modelo tridimensional de
la estructura de la bacteriorrodopsina, que mostraba
cómo la cadena de proteína se movía a través de la
membrana
Era
la mejor imagen de una proteína generada utilizando un
microscopio electrónico. Muchas personas quedaron
impresionadas con la resolución, que fue de 7 Ångström
(0.0000007 milímetros), pero esto no fue suficiente
para Richard Henderson. Su objetivo era lograr la
misma resolución que la proporcionada por la
cristalografía de rayos X, de aproximadamente 3
Ångström, y estaba convencido de que el microscopio
electrónico tenía más que ofrecer. |
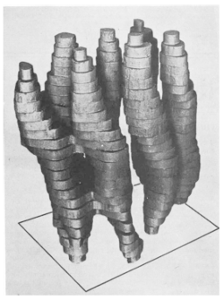
El
primer
modelo
aproximado de bacteriorodopsina, publicado en 1975.
Imagen
de Nature 257: 2 8 -32 |
|
|
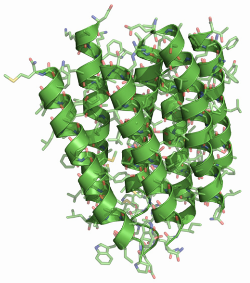
En
1990, Henderson presentó una estructura de
bacteriorrodopsina con resolución atómica. |
Richard Henderson fue agregando poco a poco más
detalles al modelo de bacteriorrodopsina. Finalmente,
en 1990, 15 años después de haber publicado el primer
modelo, Henderson logró su objetivo y pudo presentar
una estructura de bacteriorrodopsina con resolución
atómica.
Demostró que la cryo-EM podría proporcionar imágenes
tan detalladas como las generadas utilizando
cristalografía de rayos X, lo cual fue un hito
crucial. Sin embargo este progreso se basó en una
excepción: que la proteína se empaqueta naturalmente
de manera regular en la membrana. Pocas proteínas se
ordenan espontáneamente de esta manera. La pregunta
era si el método podría generalizarse:¿sería posible
usar un microscopio electrónico para generar imágenes
3D de alta resolución de proteínas que se dispusieran
al azar en la muestra orientándose en diferentes
direcciones? Richard Henderson creía que sí, mientras
otros pensaban que esto era una utopía.
|
|
|
Al
otro lado del Atlántico, en el Departamento de Salud
del Estado de Nueva York, Joachim Frank
había trabajado durante mucho tiempo para encontrar
una solución a ese problema.
En
1975, presentó una estrategia teórica donde la
información, aparentemente mínima, encontrada en las
imágenes bidimensionales del microscopio electrónico,
podría fusionarse para generar un todo tridimensional
de alta resolución.
La
estrategia de Joachim Frank se basa en discriminar,
mediante un programa informático, entre las proteínas
colocadas al azar y el fondo borroso del microscopio
electrónico. Desarrolló un método matemático que
permitía al ordenador identificar diferentes patrones
recurrentes en la imagen. Luego el ordenador clasifica
patrones similares en el mismo grupo y fusiona la
información para generar una imagen promedio más
nítida. De esta manera obtuvo una serie de imágenes
bidimensionales de alta resolución que mostraban la
misma proteína pero desde diferentes ángulos. Los
algoritmos del software se completaron en 1981.
El
siguiente paso fue determinar matemáticamente cómo
fusionar las diferentes imágenes bidimensionales entre
sí y para obtener una imagen 3D. Frank publicó esta
parte del método de análisis de imágenes a mediados de
la década de 1980 y la utilizó para generar un modelo
de la superficie de un ribosoma, la gigantesca
maquinaria molecular que construye proteínas en el
interior de la célula.
El
método de procesamiento de imágenes de Joachim Frank
fue fundamental para el desarrollo de cryo-EM.
Daremos ahora un salto de unos años hacia atrás. |
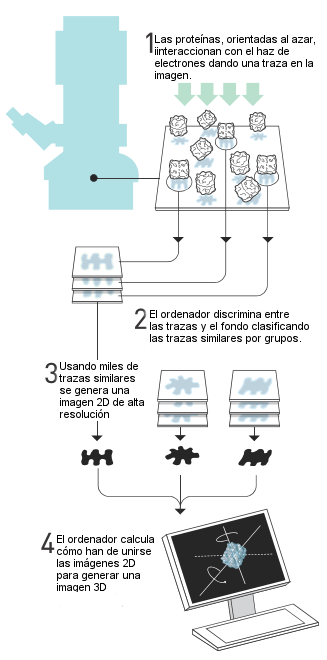
El
método de Frank para obtener imágenes 3D |
|
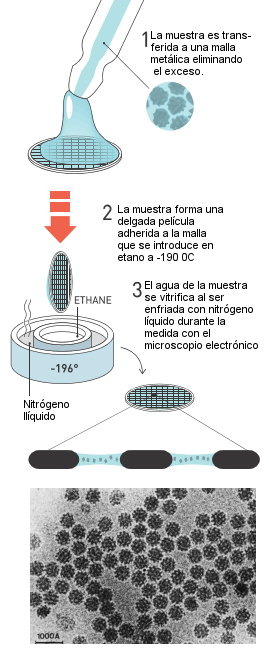
Dubochet obtuvo la
primera imagen de un virus por vitrificación del agua
en 1984.
Imagen de Nature 308: 32-36 |
Al
tener que trabajar en vacío La vaporización del agua
era un gran problema. Sin embargo, Jacques
Dubochet vio una posible solución: enfriar el
agua tan rápidamente que se solidificara para formar
un vidrio en lugar de un cristal. Un vidrio parece un
material sólido, pero en realidad es un fluido ya que
sus moléculas están desordenadas. Dubochet se dio
cuenta de que si pudiera obtener agua vitrificada, el
haz de electrones se difractaría uniformemente y
proporcionaría un fondo uniforme.
Inicialmente, el grupo de investigación intentó
vitrificar pequeñas gotas de agua en nitrógeno líquido
a -196 ° C, pero el éxito llegó cuando reemplazaron el
nitrógeno por etano que, a su vez, se había enfriado
con nitrógeno líquido. Bajo el microscopio vieron una
gota que no se parecía a nada que hubieran visto
antes. Primero supusieron que era etano, pero cuando
la gota se calentó ligeramente, las moléculas se
reorganizaron repentinamente y adquirieron la familiar
estructura de un cristal de hielo. Fue un triunfo, ya
que algunos investigadores sostenían que era imposible
vitrificar las gotas de agua. Ahora creemos que el
agua vitrificada es la forma más común de agua en el
universo.
Después de los descubrimientos de 1982, el grupo de
investigación de Dubochet desarrolló rápidamente la
base de la técnica que todavía se usa en cryo-EM.
Disolvieron sus muestras biológicas, inicialmente
diferentes formas de virus, en agua. La solución se
depositó luego en una fina malla metálica formando una
película delgada. Usando un dispositivo similar a un
arco, dispararon la red en el etano líquido para que
la delgada película de agua se vitrificara.
En
1984, Jacques Dubochet publicó las primeras imágenes
de varios virus diferentes, redondos y hexagonales,
que se podían observar en marcado contraste con el
fondo de agua vitrificada. El material biológico ahora
podría prepararse con relativa facilidad para el
microscopio electrónico, y los investigadores pronto
llamaron a la puerta de Dubochet para aprender la
nueva técnica. |
|
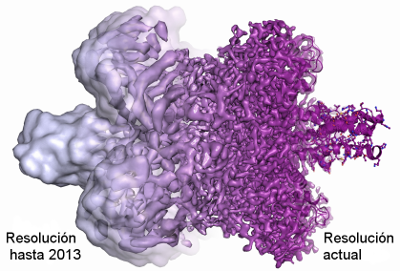
Debido a que cryo-EM raramente podía visualizar otra
cosa que no fuera una superficie desigual, el método a
veces se llamaba "blobología" (término que quiere
poner de manifiesto lo borroso (“blob”) de las
imágenes obtenidas). Sin embargo, y en gran parte
debido a que Richard Henderson mantuvo obstinadamente
que el microscopio electrónico proporcionaría
rutinariamente imágenes que mostrarían átomos
individuales, se ha optimizado, poco a poco, cada
tuerca y cada tornillo del microscopio electrónico
logrando una mejora de la resolución hasta que el
obstáculo técnico final se superó en 2013, cuando se
puso en uso un nuevo tipo de detector de electrones.
Ahora
el sueño es realidad y nos enfrentamos a un desarrollo
explosivo de la bioquímica. Hay varias cosas que hacen
que la cryo-EM sea tan revolucionaria: el método de
vitrificación de Dubochet es relativamente fácil de
usar y requiere un tamaño de muestra mínimo. Debido al
rápido proceso de enfriamiento, las biomoléculas se
pueden congelar de forma casi instantánea lo que
permite tomar series de imágenes que capturan las
diferentes partes de un proceso. De esta forma,
producen 'películas' que revelan cómo las proteínas se
mueven e interactúan con otras moléculas. |
 |
|
|
|
|
Jacques
Dubochet, Joachim Frank y Richard Henderson, a través de
su investigación, lograron "un gran beneficio para
la humanidad". Actualmente cada rincón de la célula se
puede observar a nivel atómico y la bioquímica está lista
para un futuro emocionante. |
|
|