|
En
1971 Yves Chauvin logró explicar con detalle el mecanismo de la
reacción de metátesis.
Un
compuesto con un doble enlace metal-carbono (llamado carbeno) cataliza
la reacción formando con las olefinas compuestos cíclicos intermedios
que tras su apertura rinden como producto final nuevas olefinas en las que
algunos átomos o grupos atómicos se han intercambiado (ver esquema de la
reacción en el lateral)
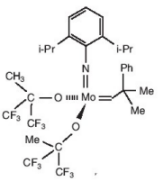
Richard Schrock investigó durante muchos años la posibilidad de
construir catalizadores conteniendo diferentes metales tales como el tántalo,
tungsteno y molibdeno. En 1990 comunicó que su grupo había logrado la
construcción de un catalizador de molibdeno cuya elevada actividad se atribuía
a los grupos enlazados al átomo metálico.
|
 |
|
Uno de los catalizadores de
molibdeno
diseñados por Schrock |
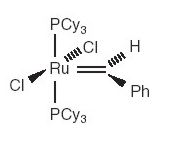
Dos años más tarde (1992) Robert
Grubbs desarrolló catalizadores que tenían como elemento metálico al
rutenio. Eran estables al aire y mostraban una alta selectividad. Estos
catalizadores eran también útiles para iniciar reacciones de metátesis en
presencia de alcoholes, agua y ácidos carboxílicos y se han mostrado como los
principales catalizadores usados para aplicaciones generales de las reacciones
de metátesis en los laboratorios.
|
 |
|
Catalizador de rutenio desarrollado por
Grubbs |
La
reacción de metátesis es usada a diario en la industria y gracias a la
contribución de los laureados la reacción es ahora más eficiente (requiere
menos pasos, menos recursos...) más simple (estabilidad en el aire, se
verifica a temperatura y presión normal) y menos dañina para el medio ambiente
(disolventes no dañinos, residuos menos contaminantes...). Todo esto
representa un gran paso hacia la llamada "química verde". La reacción de
metátesis puede ser considerada como un ejemplo de cómo la ciencia básica
puede usarse en beneficio de las personas, la sociedad y el medio ambiente.
|